致病菌劫持并内化入宿主细胞造成持续感染和继发感染。病原菌和宿主细胞本质上都生活在复杂的物理力学微环境中,近年来越来越多的研究表明:细胞外基质物理力学微环境(例如流体剪切力、渗透压、机械拉伸、界面粘附力以及细胞外基质刚度)在调节细菌和宿主细胞的生理病理功能和行为方面起着至关重要的作用。然而,细胞外基质刚度等力学微环境因素如何调节细菌感染及抗菌治疗的力学生物学机制尚不明晰。
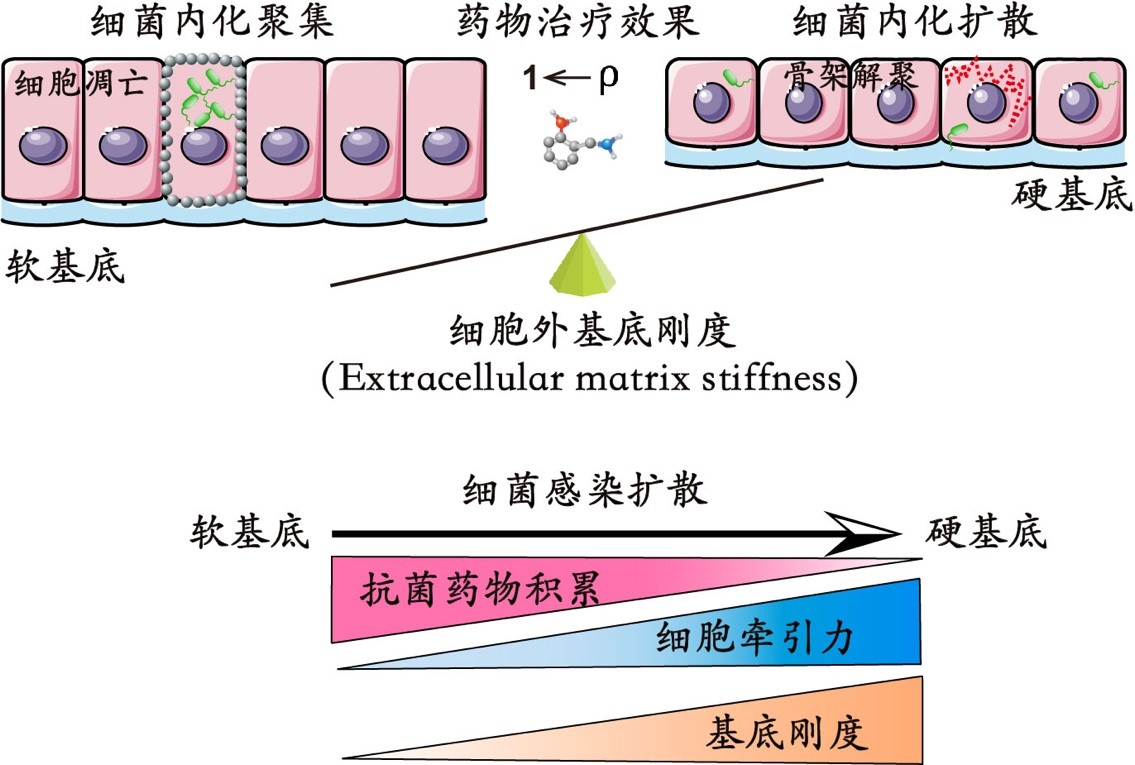
图1:细胞外基底刚度调控细菌内化模式和抗菌药物治疗示意图
2021年8月27日,33678新甫京国际品牌黄建永研究员课题组在Biomaterials杂志上在线发表了题为“Extracellular matrix stiffness modulates host-bacteria interactions and antibiotic therapy of bacterial internalization”的研究论文,从力学生物学视角揭示了细胞-细菌相互作用的时空动态特征和规律,在此基础上定量探究基底刚度对于内化的细菌抗生素治疗的调节作用和机制(图1)。实验发现基底刚度会调控细菌对宿主细胞感染模式转变,细菌倾向于感染细胞片层中相对高牵引力区域的细胞;基质刚度会调节细菌感染的时空动态和感染程度,在相对软的基底上易于诱发局部严重感染和细胞凋亡,而在相对硬的基底上通常诱发弥散性感染和细菌侧向传播。该文也同时甄别了细胞牵引力、细胞骨架、细胞膜上相关黏附分子在其中所起到的关键作用,并由此揭示了基底刚度对于细菌抗生素治疗的潜在影响和调节机制。动物实验进一步证实了基底刚度在细菌感染宿主细胞过程中的重要调控作用。上述工作不仅揭示了基质刚度对于细菌感染的关键调控作用,也为从力学生物学角度改善临床对多药耐药细菌的抗生素治疗提供了新的思路。
为了明晰细胞外基质刚度是如何调控细菌内化的入侵规律,研究人员首先建立了一种基于柔性基底的细胞-细菌互作模型,结果发现随着基底刚度增加内化菌的细菌总量反而减少,基底杨氏模量(E)与内化菌侵染细胞的数量(NIB)呈现线性依赖关系。在较软的细胞外基质微环境中,病原菌呈现出聚集性感染模式(伴随内化细菌数量增加),而在较硬的细胞外基质微环境中,病原菌倾向于弥散性感染宿主细胞(但内化细菌数量却减少)。研究人员随后定量表征了细菌内化内皮细胞单层过程中的细胞牵引力时空变化规律,结果显示细菌入侵内皮细胞单层后其细胞牵引力都会显著降低(在软或者硬基底上均是如此),但有趣的是,内皮细胞单层中具有相对较大细胞牵引力的上皮细胞个体更容易受到细菌攻击和入侵,表明细菌内化细胞单层的过程与细胞牵引力(及细胞内F-Actin骨架等)具有特定关联性。
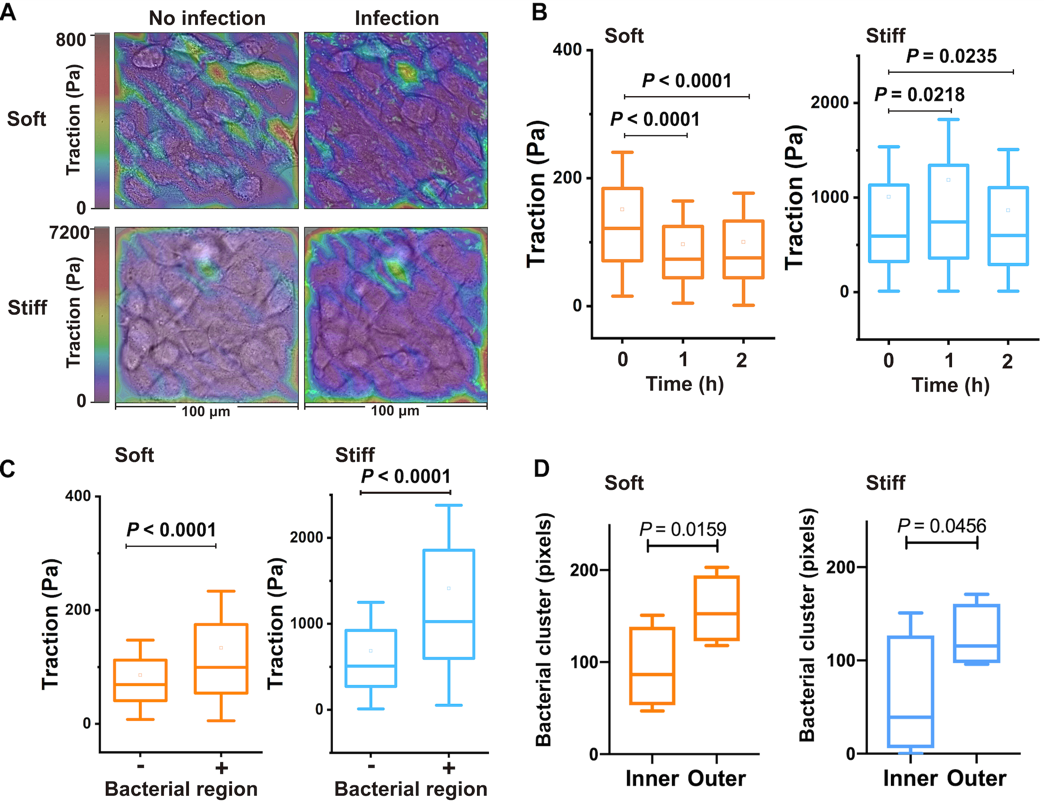
图2:细菌牵引力决定了细菌在单层细胞上内化方式
(A)不同软硬基底感染前后细胞牵引力的测定(B)细胞牵引力随时间变化图(C)细菌在细胞牵引力大的位点内化(D)细菌在细胞牵引力大的细胞单层外侧内化
研究人员进一步揭示了细胞外基质刚度如何调控抗菌药物对于内化菌感染治疗的力学生物学规律。通过选取两种常见的广谱抗菌药物(环丙沙星和四环素)对处于不同刚度微环境下的感染细胞单层进行治疗,试验结果发现较软的基质微环境更易于抗菌药物的药效发挥,能更高效的清除内化细菌。鉴于脂溶性高的药物治疗内化菌效果好,研究人员猜测抗菌药物治疗内化菌的疗效应该取决于其进入细胞的浓度,也即存活于细胞内的内化菌的治疗与抗菌药物在细胞内积累的浓度直接相关。为此,该文通过液相色谱-串联质谱(LC-MS)分析量化了细胞内抗菌药物积累量,结果表明处于较软基质微环境中的内皮细胞单层内抗菌药物的积累量更高,相应的药物功效也更好。软基质上细胞单层内的抗菌药物浓度基本都达到了1个MIC值(即四环素的胞内蓄积超过2 μg/mL,环丙沙星胞内蓄积超过1 μg/mL),预示着基质微环境刚度的降低(例如局部病灶组织的软化)有助于抗菌药物更有效地清除内化的细菌。
综上所述,该文报道了细胞外基质刚度对于病原菌入侵内化宿主细胞的时空调控规律,发现了基质刚度主导病原菌聚集性/弥散性入侵宿主细胞的内在机制,揭示了抗生素在细胞内累积及其对内化细菌清除效率与基质力学微环境因素之间的定量依赖关系。上述工作不仅对于更加精准地控制抗生素使用、避免因抗生素使用过度而导致耐药性的产生具有一定参考价值,也为从力学生物学角度改善多药耐药细菌的抗菌药物治疗方案提供了新的思路。
33678新甫京国际品牌博士后刘晓晔(现在为北京农学院讲师)为该论文第一作者,黄建永研究员为通讯作者,该工作得到了中国农业大学朱奎教授的大力支持和帮助。
原文链接:https://www.sciencedirect.com/science/article/pii/S0142961221004543。










